
CAR-T细胞疗法是肿瘤界一颗冉冉升起的新星,它有望成为癌症的终极疗法。然而,目前的CAR-T疗法存在着三个重要缺陷:靶向性差、适应能力有待提高、响应强度无法灵活调节。针对这些问题,波士顿大学的华人科学家Wilson W. Wong教授带领的团队研发出了一种新型CAR-T细胞(SUPRA CAR-T细胞),其特点是“分离、通用、可编程”。它能够自发“升级”结合多种抗原,不需要人们对它进行重编程,它就能够改变攻击的靶点,变异的肿瘤细胞也逃不过它的法眼。它也可以自动调节T细胞的活性,将治疗的副作用降至最低。它还能够根据不同的细胞类型,控制细胞特异的信号传导。这些特性有助于它阻止肿瘤复发、降低副作用,以及提高特异性。
SUPRA CAR-T系统的设计
这个超级CAR由两种成分组成,一个是T细胞表面的“通用”受体,另一个是专门靶向肿瘤细胞的“适配器”分子。“通用”受体包括胞内信号域和胞外亮氨酸拉链,肿瘤“适配器”则包括同源亮氨酸拉链和单链抗体。单链抗体与肿瘤表面的抗原结合,“适配器”亮氨酸拉链再去结合通用受体的亮氨酸拉链,激活通用受体。SUPRA CAR-T细胞与以往用于治疗的CAR-T细胞不同的地方在于,它能不经过“重编程”就对多种抗原作出反应,有效抑制肿瘤复发。当肿瘤细胞出现靶点基因突变时,研究人员只需要向患者体内注入一批新抗体,而不必对T细胞进行重编程。这大大节约了治疗的费用。
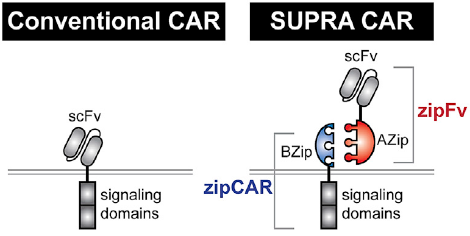
图1 常规CAR和超级CAR的比较
这个分离的CAR设计有一个特点,即,它能够通过多种机制调节T细胞的活性,例如调节“通用”受体胞外区或“适配器”分子亮氨酸拉链亲和性、调节肿瘤抗原和“适配器”亲和性、改变“适配器”分子浓度、调节“通用”受体的表达。Wong教授团队检测了SUPRA CAR系统靶向多种抗原的能力。首先,他们对人源初始CD8+ T细胞进行了编程,使它表达RR通用受体。然后,他们设计了三个不同的“适配器”,它们分别靶向三个常见的肿瘤抗原α-Her2、α-Axl和α-间皮素。编程的CD8+ T细胞在体外与表达Her2、Axl和间皮素的髓系白血病细胞共培养,研究人员加入了“适配器”分子后,T细胞杀死了相应的肿瘤细胞。
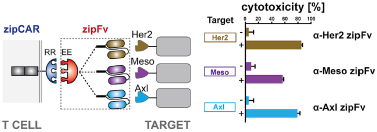
图2 SUPRA系统借助不同的“适配器”分子,靶向多个抗原。
调节SUPRA CAR-T活性的竞争性“适配器”
许多接受CAR-T细胞疗法的患者都会遭遇细胞因子风暴,严重时可致命,因此调节CAR-T细胞活性就成为了目前科研工作中的一个重点。Wong教授团队使用一种竞争性的“适配器”分子,去结合其他的“适配器”分子,抑制T细胞表面“通用”受体的活性。
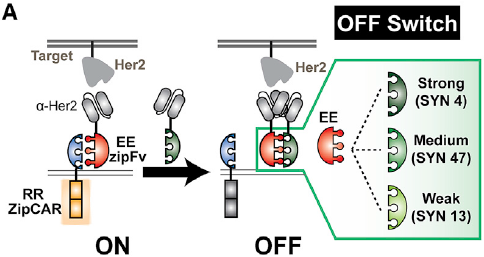
图3 抑制超级CAR系统活性的竞争性“适配器”
三种竞争性亮氨酸拉链均可结合至靶向肿瘤的“适配器”,它们的亲和性不同,所以对T细胞抑制的程度也不同。
SUPRA CAR-T系统的控制
对肿瘤的靶向治疗而言,“脱靶”一直是一个亟待解决的问题。科学家们一直使用肿瘤细胞表面的CD19 + Her-2、CD19 + CD20等分子去识别癌细胞。最近,也出现了识别CD22和CD123的CAR。然而,肿瘤细胞仍可通过关闭或下调这些分子的表达躲过免疫系统的攻击。因此,人们需要对T细胞进行重编程,使它能够靶向癌细胞表面的其他抗原。SUPRA CAR-T细胞的问世,让人们不需要对T细胞进行基因上的改造,就能使它靶向不同的抗原。
肿瘤靶向治疗的另一个局限性在于识别单一特异性抗原,它决定了肿瘤的特征和毒性。目前已研发出可识别多种抗原的CAR-T细胞,这提高了CAR-T细胞疗法的特异性。然而,这些受体针对的抗原过于单一,T细胞靶向治疗的风险不容忽视。研究人员使用了Axl作为安全性标志物,将它与Her-2“适配器”分子相结合,使Her-2“适配器”分子无法与通用受体反应,保护了Her2+/Axl+的细胞。
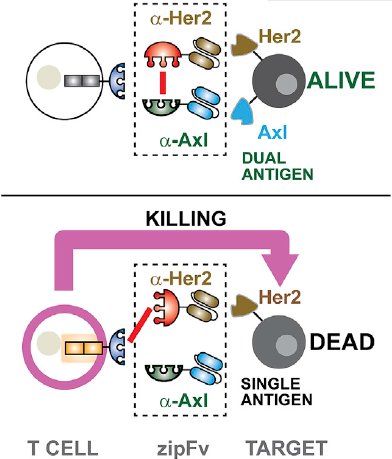
图4 超级CAR用于细胞选择
Axl作为安全性标志物,能够抑制超级CAR-T细胞活性。
新型CAR-T细胞的出现,有望提高细胞疗法的灵活性、特异性和安全性。它能够不经过“重编程”的步骤,直接靶向多种抗原。而SRPRA CAR的灵活性和功能性,又是目前所有生物分子标记的抗体中最高的。希望这种能够靶向多种抗原、控制T细胞活性以及控制多种细胞特异性信号通路的SUPRA CAR系统能够早日用于临床治疗,为广大患者带来福音!
参考文献
Cho et al., Universal Chimeric Antigen Receptors for Multiplexed and Logical Control of T Cell Responses, Cell (2018), https://doi.org/10.1016/j.cell.2018.03.038
尊敬的 先生/女士
您已注册成功,注册信息及注意事项已发到联系人及参会人邮箱,请注意查收。如未收到,请联系大会联系人。