心脏三维细胞培养系统创新的现状
(世联博研公司细胞力学部分)
| 产品名称:心脏三维细胞培养系统创新的现状 |
| 品牌: |
| 货号: |
| 价格:询价 |
| 联系人:陈经理 |
| 电话:13060393900 |
心脏三维细胞培养系统创新的现状 (世联博研公司细胞力学部分) 在体外充分复制人体组织结构的道路上,一个必要的步骤是形成复杂的3D结构。单细胞生长在比人体更坚硬的表面上,其行为不太可能与体内的细胞相似。形成3D结构的一个简单方法是形成你感兴趣的细胞的球体体或有机体。在这里,我们解读术语中的微妙之处,描述心脏器官和球状体文献的新进展,并讨论创造和培养球状体和类器官的新技术。 Spheroids vs. organoids: what’s the difference??
虽然术语偶尔会互换使用,但它们的意思并不完相同。他们都指定了自组装的细胞球。然而,有机体可以被认为是一种特殊的球体类型。典型的器官来源于体外干细胞的球状体,这些干细胞已经分化成许多细胞类型和组织层,可以存在于成年器官中。 [1] . 以这种方式,心脏球体通常由分化心肌细胞自组装而成,可能加入成纤维细胞、内皮细胞和平滑肌细胞,以更好地模仿成人心脏的细胞组成。心脏器官,另一方面,将形成和分化多功能干细胞。有机体的细胞组成不会像球状体那样被控制。然而,原位细胞的分化,无论是自发的还是受化学因素引导的,通常将使细胞形成更复杂的结构,在分化的不同阶段,细胞类型的多样性更大。 心脏器官:的技术是什么?
心脏器官是从一个或几个多能干细胞分化出来的细胞球。这些有机体形成的机制模拟了胚胎发生过程中的发展 [2] .心脏器官通常会暴露于多种因素的混合物中,这些因素将驱动细胞通过心脏的发育阶段,典型的是通过调节wnt通路。使用GSS-抑制/WNS-抑制方案,可以产生类似早期心肌生成的关键阶段的心脏器官,如中胚层规范、中胚层诱导和心脏腔形成。 [2] .以这种方式生成的心脏器官含有多种细胞亚型,如心肌细胞、内皮细胞、心内膜细胞、平滑肌细胞和心外膜细胞,包括内皮衍生物 [2] . 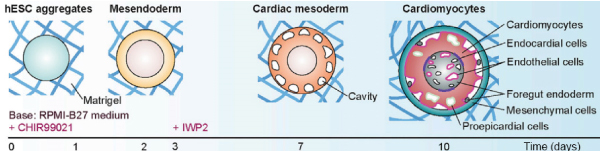 图1 心脏器官分化阶段 [3] 使用德拉赫利斯等人制定的协议。 [4] 图改编自金姆等人。 [3] Stages of differentiation of cardiac organoids[3] using a protocol developed by Drakhlis et al.[4] Figure adapted from Kim et al.[3] 近的分化协议使得多室心脏器官(称为心脏)的形成成为可能。 [5] .这一进展使心脏器官的复制生成在类似病毒的基因表达谱、形态和功能中具有细胞块特异性。明显地,心脏样体的区域与心房、左心室和右心室相似。这些令人印象深刻的细胞生物学的成就应该具有不可思议的潜力来解决那些影响心脏腔的形成、心脏腔间的相互作用以及胚胎发生过程中区域特有的心脏变形的疾病。 心脏球体:的技术是什么?
与心脏器官不同的是,心脏球体的细胞构成是由用于制造球体的终分化细胞决定的。包括心脏球体在内的准确细胞类型仍有待讨论。人们普遍认为,心脏中的所有主要细胞类型都应包括在内。然而,心脏是一个异质器官,不同区域的细胞类型略有不同。另外,心肌细胞的作用是明显的,其他细胞在心脏的作用则不那么明显。例如,心脏成纤维细胞几乎肯定起着结构作用,例如沉积心脏细胞外基质。近的报告指出了内皮细胞的作用,这些细胞超越了其作为血管细胞的功能 [6].研究人员可能需要根据研究人员感兴趣的心脏区域调整细胞类型及其比例。尽管如此,已经进行了一些研究,以确定除心肌细胞外的细胞包涵对心脏球体表型的影响。 包括海马内皮细胞、平滑肌细胞和心肌成纤维细胞在内的心球细胞表现为增强活力、肌肉瘤成熟和心肌细胞能量。 [7] .由四种细胞组成的球状体也显示出更大的场电位持续时间和传导速度。 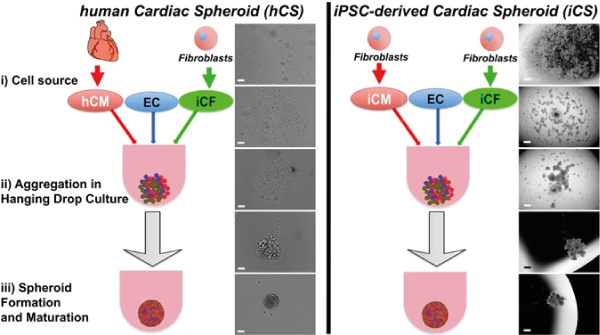 图2 :由人类原发细胞(左)和分化为IPSC的细胞(右)形成心脏球体。图改编自波隆楚克等人。 [8] Figure 2: Formation of cardiac spheroids from human primary cells (left) and cells differentiated from iPSCs (right). Figure adapted from Polonchuk et al.[8] 心细胞球形体可以再现人体心脏组织的细胞组织、细胞外基质和微血管网络。 [8] .在一项研究中,比较了由成年人心肌细胞和IPSC衍生的心肌细胞(与原始内皮细胞和IPSC衍生的心脏成纤维细胞共同培养)所产生的球状体,PolonSchk等人显示了形成由内皮细胞组成的微血管化网络的迹象。
选择要使用的细胞和暴露于心脏球体的因素的混合物也可以用来建立特定疾病的体外模型。研究人员用已知的前纤维化剂TGF-贝塔治疗他们的球状体,创造了由新生大鼠心脏细胞制成的心脏球体,用于纤维化研究。 [9] . 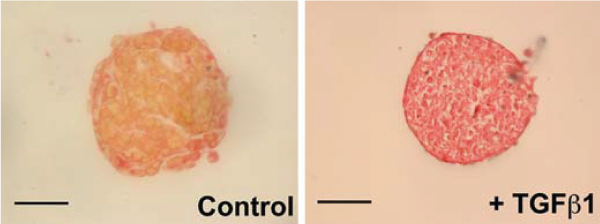 图3 *肌肉染色 心球体的(黄色)和ECM(红色)成分。主要的红色染色与原纤维化剂TGF-贝塔演示了一个纤维化疾病模型的创建。标尺吧,100米的立体版。 Figure adapted from Figtree et al。 [9] 球状体和有机体:它们是如何被创造的?它们是如何被培养的?
培养球体存在许多技术,每种技术都有其优势和局限性 [10] .基本的必要条件是,必须防止细胞粘在表面,以防止它们扩散到一个单层。这可以通过将细胞培养在具有非粘附表面的容器中,或者通过将细胞保持在悬浮状态,使它们不会与表面接触来实现。这两者的例子载于 图4 .然而,这些技术的主要缺点是细胞的培养基需要补充,在某些情况下,该培养基需要加药。由于球体有丢失的危险,因此必须谨慎地使用典型的处理技术(抽吸后再抽吸新溶液)。 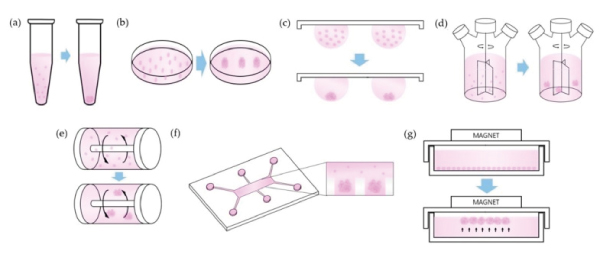 图4 球组织培养悬浮液中保存细胞聚集体的技术。图改编自Ryu et al.等人。 [10] 还以混合形式取得了令人印象深刻的结果,即细胞的附着被限制在二维,从而形成了"2.5d"结构。在一份出版物中,作者使用人类的IPSC微模式在盘状上形成了跳动的人类心脏微室 [11] 受到图案几何的限制。细胞分化取决于细胞在微模式中的位置,周围的细胞环表达八分之四,表明在微模式的中心失去多能性。 虽然作者准备了他们自己的微图案表面,商业解决方案是现成的( 抗氧化微模式 ). 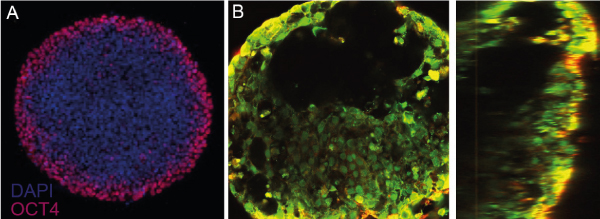 图5:微图案有机体。(a)在微模式的边缘失去八分之四表达表明丧失多能性。(盘状微图案,直径600毫米。(b)按照分化协议,在顶部(左侧)和侧面(右侧)的视图中可见没有细胞的微室。Figure adapted from Ma et al。 [11] 近的平台使每一口井形成多个均匀的球状体,采用多井板形式,适合高含量筛选,如安性或毒性研究。更的由4dSor开发的板块在微井底部有一个接触点,使球体锚定在原地,同时保持其3D格式。这个接触点允许介质改变,而不干扰细胞,或失去细胞的风险。球体周围有一个可调谐刚度的水凝胶,模仿人体组织的机械性能。此外,均匀的尺寸分布使得许多几乎相同的球体或有机体可以同时进行研究。在尺寸上的均匀性对于有机体尤为重要,因为初的干细胞球状体的大小决定了细胞随后的分化。 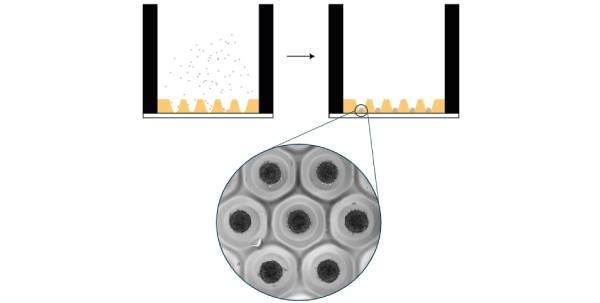 图6:4 4Dcell SmartSphero Plates创造了均匀的球体体,锚定在一个小(~100um)接触点上,在介质交换过程中不会丢失。 参考资料
|